血液病的“量体裁药”:个体化用药如何改写治疗结局?
基因检测仪器的指示灯在实验室里静静闪烁,一份急性髓系白血病患者的骨髓样本正被深度解码。几天后,医生根据发现的FLT3基因突变,为这位65岁患者避开了传统化疗,选择精准靶向药物。
曾经“千人一方”的血液肿瘤治疗方式正在被彻底颠覆。在传统治疗时代,医生们面对复杂的血液疾病时往往采取标准化疗方案,如同“试错”般寻找可能有效的治疗路径。患者则承受着药物毒副作用与疗效不确定的双重煎熬。
如今,随着基因测序技术和靶向药物的飞速发展,“一人一策”的个体化用药模式已成为现实。这种精准医疗手段不仅显著提升了治疗效果,更让许多原本束手无策的复发难治性血液病患者重获生机。
01 为何血液病急需“量体裁药”?
血液系统恶性肿瘤具有惊人的异质性特征。即使是同一诊断名称的疾病,在不同患者身上可能表现出完全不同的分子特征、疾病进程和治疗反应。这种多样性使得传统“一刀切”的治疗方式难以满足现代医疗需求。
急性髓系白血病(AML)的治疗变革生动诠释了这种转变的必要性。中国人民解放军联勤保障部队第920医院王三斌教授指出:“传统化疗方案的地位正面临重新评估。新型靶向药物驱动了治疗模式的深刻变革。”
在老年AML领域,个体化用药尤为关键。老年患者常合并多种基础疾病,对高强度化疗耐受性差。而分子靶向药物的出现使低强度治疗策略成为可能,显著改善了这些患者的生存质量。
2025版骨髓增生异常综合征(MDS)指南的更新进一步凸显精准诊断对个体化治疗的基础作用。指南强调:“仅存在细胞遗传学异常不能作为诊断MDS的确切证据。”这一修订避免了过度诊疗,确保治疗方案与患者实际病情精准匹配。
02 个体化用药的核心武器,分子靶向与细胞治疗
分子靶向药物如同精确制导导弹,能够精准干扰癌细胞生长和存活的特定通路。这些药物根据患者基因检测结果“量体裁药”,大幅提高疗效同时减少副作用。
在AML治疗领域,靶向药物已经形成“精确制导武器库”:
FLT3抑制剂:针对FLT3基因突变型AML
IDH1/2抑制剂:用于IDH突变患者
BCL-2抑制剂(如维奈克拉):适用于特定遗传背景的老年患者
MENIN抑制剂:新一代靶向药物,拓展治疗边界
王三斌教授团队建立了基于FLT3、NRAS、KRAS及TP53等基因突变状态的评估体系。研究表明,在低强度治疗时代,IDH1、IDH2以及DDX41等基因突变患者预后良好,这一发现促使预后评估体系动态调整,实现真正的精准医疗。
慢性淋巴细胞白血病(CLL)的个体化治疗策略则聚焦于平衡疗效与生活质量。传统化疗正被新型靶向药物取代:
布鲁顿酪氨酸激酶抑制剂(BTK抑制剂)
BCL-2抑制剂
固定疗程联合方案
MRD引导的按需治疗
丹麦哥本哈根大学医院的Carsten Niemann教授指出:“即使是治疗相关腹泻这类‘小问题’,对需长期维持治疗的患者也可能造成重大生活困扰。通过分子标志物筛选可更精准匹配治疗方案。”
细胞免疫治疗代表了另一种个体化治疗范式。CAR-T疗法通过基因工程技术改造患者自身T细胞,使其能精准识别并杀伤肿瘤细胞。在复发/难治性白血病、淋巴瘤和骨髓瘤等血液肿瘤中,这种“活细胞药物”展现出突出疗效。
近期我国医疗团队在CAR-T领域取得突破性进展。华中科技大学同济医学院附属协和医院开发了“体内制备CAR-T”技术,相比传统体外制备方法,简化了操作流程,降低了成本。在治疗多发性骨髓瘤的临床试验中,该技术实现了100%总体有效率,其中2例达到严格意义上的完全缓解状态。
表:主要血液疾病个体化治疗策略与代表药物
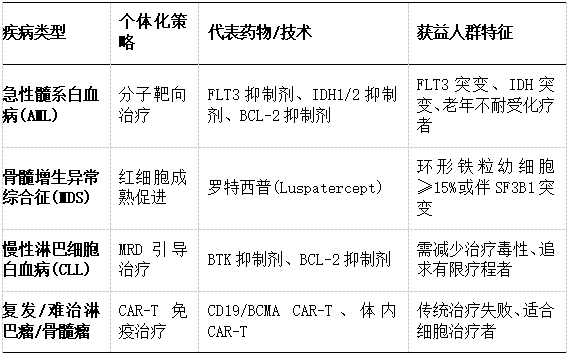
骨髓增生异常综合征(MDS)的个体化治疗则聚焦于贫血管理。2025版指南中,新型红细胞成熟剂罗特西普的推荐级别显著提升。根据COMMANDS研究数据,罗特西普在实现输血独立性(59% vs 31%)和延长缓解时间(127 vs 77周)方面显著优于传统促红细胞生成剂。
这种优势在特定亚群中尤为突出:SF3B1突变患者响应率达70%,环形铁粒幼细胞阳性患者达65%。而对于非RS/SF3B1野生型患者,两种药物疗效相当,凸显了基于分子特征选择治疗方案的重要性。
我国学者在MDS治疗领域也取得重要进展。浙江大学医学院附属第一医院血液科佟红艳教授团队开发了“重组促红细胞生成素+维A酸+十一酸睾酮”三联疗法,在61.5%的较低危MDS患者中实现血红蛋白应答,且不受患者体内EPO水平的影响。
03 多学科协作,个体化治疗的坚实后盾
个体化用药的复杂性决定了它绝非单一科室能够完成的任务。广州医科大学附属肿瘤医院成立的“血液肿瘤CAR-T治疗多学科诊疗(MDT)团队”生动诠释了这一协作模式的重要性。
该团队由肿瘤内科、放疗科、重症监护室、神经外科、病理科、检验科、影像科等多学科专家组成。团队共同制定CAR-T治疗相关制度、流程及应急预案,对患者进行联合评估与筛选,并定期召开MDT病例讨论会,制定个体化综合治疗方案。
这种协作模式对管理CAR-T治疗的独特挑战尤为关键:
细胞因子释放综合征(CRS):需重症监护团队支持
免疫效应细胞相关神经毒性综合征(ICANs):需神经专科介入
感染风险防控:需感染科专家参与
长期随访管理:需血液专科主导
“多学科协作是提升CAR-T治疗成功率的关键,”肿瘤内科主任郑燕芳教授强调。内科二区王尧副主任医师补充道:“CAR-T治疗不仅需要精准筛选患者,还需精细管理治疗过程,多学科协作有助于降低风险、提高疗效。”
04 未来展望,个体化用药的挑战与方向
尽管血液病个体化用药取得显著进展,我们仍面临诸多挑战。如何预测长期疗效、避免耐药、降低治疗成本,以及如何将精准治疗推广至医疗资源匮乏地区,都是亟待解决的问题。
在ITP(原发免疫性血小板减少症)领域,北京大学人民医院张晓辉教授指出了关键问题:“我们团队针对大剂量地塞米松+X方案开展了一系列临床研究,目前已取得显著的临床疗效。然而,在5年完全缓解率方面仍需突破。”他倡导未来建立分层诊断和分层治疗体系,从分子标志物层面进行亚型划分,制定针对性治疗策略。
新型生物标志物的发现将成为未来个体化治疗的关键。昆明医科大学第二附属医院周泽平教授表示:“我们有望通过对特定新诊断ITP患者群体的深入研究,特别是结合能够预测疾病慢性化进程的生物标志物,制定个体化的联合治疗方案。”
治疗可及性是另一重要挑战。目前许多创新药物和治疗方案价格昂贵,限制了广泛应用。我国自主研发的体内CAR-T技术为降低成本提供了新思路,该技术“无需单采和清淋即可实现人体内T细胞的高效改造”,简化了流程,节省了费用。
随着人工智能和大数据技术在医疗领域的应用,个体化用药将进入新阶段。通过分析海量患者数据,AI系统能够为医生提供更精准的治疗建议,帮助匹配最佳治疗方案。
河南省肿瘤医院周虎教授指出:“基于此,我们致力于在现有治疗方案基础上联合其他药物进行优化,以期帮助患者实现疾病的长期控制,使其能够重返正常生活和工作,减少因疾病反复发作导致的频繁就医。”
展望未来,随着基因编辑技术如CRISPR的成熟和新型免疫疗法的发展,血液病的个体化治疗将更加精准高效。科学家们正在探索离体编辑造血干细胞治疗遗传性血液病的方法,以及开发通用型CAR-T产品,这些突破将进一步推动个体化用药的发展。
血液病个体化用药的变革不仅体现在治疗方法上,更代表着医疗理念的转变——从关注疾病本身转向关注患病的人。这种“以患者为中心”的医疗模式,将在保证疗效的同时,最大限度地提升患者生活质量,让曾经令人望而生畏的“血癌”逐渐转变为可长期管理的慢性疾病。
对于血液病患者而言,积极配合基因检测、与医生充分沟通个人情况和治疗偏好、严格遵循个体化治疗方案,将最大化治疗效益,在这场对抗血液病的精准医疗革命中赢得更大胜算。
血液病个体化用药正从科学概念转化为临床现实,它改变的不只是药物选择策略,而是整个治疗理念——从对抗疾病转向管理健康,从延长生命转向提升生活品质。随着基因测序成本下降和靶向药物可及性提高,这种“量体裁药”模式正逐步覆盖更广泛患者群体。
每一次基因检测报告的解读、每一次多学科会诊的讨论、每一次个体化用药的决策,都在为血液病患者重新定义生命的可能性。曾经的不治之症正逐步转变为可治、可控的慢性疾病,这正是精准医疗赋予人类最珍贵的礼物。(来源:河北燕达陆道培医院 杨梓艺)
扫一扫在手机打开当前页


 陕公网安备 61019002002074号
陕公网安备 61019002002074号